추가 임상적 성능시험 자료 등 3개월 내 제출 ‘조건부’로
보조적 수단으로만 사용…감염 여부는 의사가 최종 판단
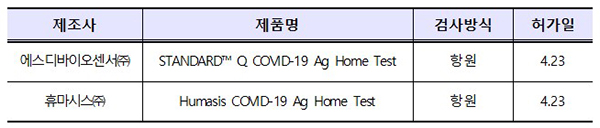
<내외매일뉴스.내외매일신문=한금실 기자> 식품의약품안전처는 23일 코로나19 자가검사가 가능한 항원방식 자가검사키트 2개 제품을 품목허가했다.
이번 제품은 국내에서 전문가용으로 허가를 받았고 해외에서는 자가검사용 임상시험을 실시해 긴급사용승인 등을 받았는데, 식약처는 추후 자가검사에 대한 추가 임상적 성능시험 자료 등을 3개월 내에 제출하도록 했다.
먼저 에스디바이오센서(주) 제품은 지난 해 11월 임상적 민감도 90%(54/60명)·특이도 96%(96/100명)로 전문가용 제조품목 허가를 받았고, 독일과 네덜란드·덴마크·스위스·포르투칼·룩셈부르크·체코 등 7개국에서 자가검사용으로 사용 중이다.
독일에서 자가검사용으로 실시한 에스디바이오센서(주) 제품의 임상적 민감도는 82.5%(33/40명)·특이도는 100%(105/105명)다.
휴마시스(주) 제품도 지난 3월 임상적 민감도 89.4%(59/66명)·특이도 100%(160/160명)로 전문가용 허가를 받았고 체코와 덴마크·오스트리아 등 3개국에서 자가검사용으로 사용되고 있다.
휴마시스(주) 제품이 체코와 브라질에서 자가검사용으로 실시한 임상적 민감도는 92.9%(52/56명)·특이도는 99.0%(95/96명)다.
민감도는 질병이 있는 환자 중 검사결과가 양성으로 나타날 확률이며, 특이도는 질병이 없는 환자 중 검사결과가 음성으로 나타날 확률을 뜻한다.
한편 이번 두 제품은 전문가가 아닌 개인이 손쉽게 자가검사를 할 수 있는 보조적인 수단으로 다양한 검사방법을 통해 감염 확산을 줄이기 위해 허가됐다. 다만 조건부 허가 제품은 정식허가 제품이 나오기 이전에 한시적으로 사용하는 제품이다.
또한 두 제품 모두 자가검사용으로 15분 내외로 결과를 확인할 수 있으나, 기존 유전자 검사(PCR) 방식 및 의료인 또는 검사전문가가 수행하는 항원 방식에 비해 민감도가 낮다는 단점이 있어 방역수칙을 철저히 준수함을 전제로 주의 깊게 사용해야 한다.
특히 코로나19 감염 증상의 확진이 아닌 보조적인 수단으로만 사용해야 하며, 유전자 검사 결과와 임상증상 등을 고려해 의사가 감염 여부를 최종 판단해야 한다.
따라서 증상이 의심되는 경우 유전자 검사를 먼저 실시해야 하며, 유전자 검사가 어려운 경우 자가검사키트로 검사를 하되 붉은색 두줄(대조선 C, 시험선 T)이 나타나는 경우 반드시 유전자 검사를 받아야 한다.
아울러 붉은색 한줄(대조선 C)이 나타나는 경우에도 감염이 의심되거나 증상이 있으면 유전자 검사를 받아야 한다.
이와 함께 사용자는 사용설명서를 충분히 숙지하고 사용방법에 따라 정확하게 사용해야 한다. 검사 결과와 무관하게 코로나19 증상이 있으면 바로 선별진료소 등을 방문해 유전자 검사를 받아야 한다.
식약처는 이번 조건부 허가제품을 대체할 품질이 우수한 정식허가 제품의 신속 개발·허가를 적극적으로 지원해 충분한 진단·치료 기회를 보장받을 수 있도록 최선을 다하겠다고 밝혔다.
[출처] 대한민국 정책브리핑(www.korea.kr)







.jpg)